Te explicamos qué son las fuerzas intermoleculares y cómo se clasifican. Además, cuáles son sus características generales y algunos ejemplos.

¿Qué son las fuerzas intermoleculares?
Se llama fuerzas intermoleculares al conjunto de fuerzas atractivas y repulsivas que se dan entre las moléculas de la materia debido, por lo general, a la presencia y distribución de sus electrones (polaridad).
Estas fuerzas se dan en la naturaleza y forman parte de los elementos y procesos involucrados en el enlace entre átomos y moléculas para alcanzar estructuras más complejas, lo cual puede darse mediante diversos tipos de procesos, que a su vez involucran distintos tipos de fuerzas.
Así, las fuerzas intermoleculares se dan entre moléculas de diversa naturaleza, determinando muchas de las propiedades físicas de la sustancia resultante, como su estado de agregación, puntos de fusión y ebullición, solubilidad, densidad, etc.
Ver además: Coloides
Importancia de las fuerzas intermoleculares
Las fuerzas intermoleculares son fuerzas fundamentales para la construcción de estructuras moleculares complejas, como las necesarias para la vida o para formar sustancias inorgánicas de diversa índole.
Además, de las fuerzas intermoleculares dependen muchas propiedades físicas de la sustancia resultante ya que determinan qué tanto se atraen entre sí las partículas mínimas de una sustancia.
¿Qué es un enlace químico?

Un enlace químico es el proceso en que dos átomos o más se juntan para formar un compuesto químico. Esto hace que la estructura resultante alcance una mayor estabilidad que la de los átomos por separado. Existen dos clasificaciones de enlaces químicos:
- Enlaces covalentes. Son enlaces químicos en que dos átomos comparten electrones de su capa exterior para formar un compuesto estable.
- No covalentes. Considerados “interacciones débiles” o de menor energía, mantienen juntos a moléculas, iones y partes de moléculas. Estos enlaces se dan por diversos tipos de fuerzas: enlaces de hidrógeno, fuerzas de Van der Waals o de dispersión de London.
Tipos de fuerzas intermoleculares
Fuerzas Ion-Ion
Se dan entre moléculas o átomos cargados eléctricamente (catión si es positiva la carga, anión si es negativa), según la regla fundamental de que iones con cargas iguales se repelen y con cargas distintas se atraen.
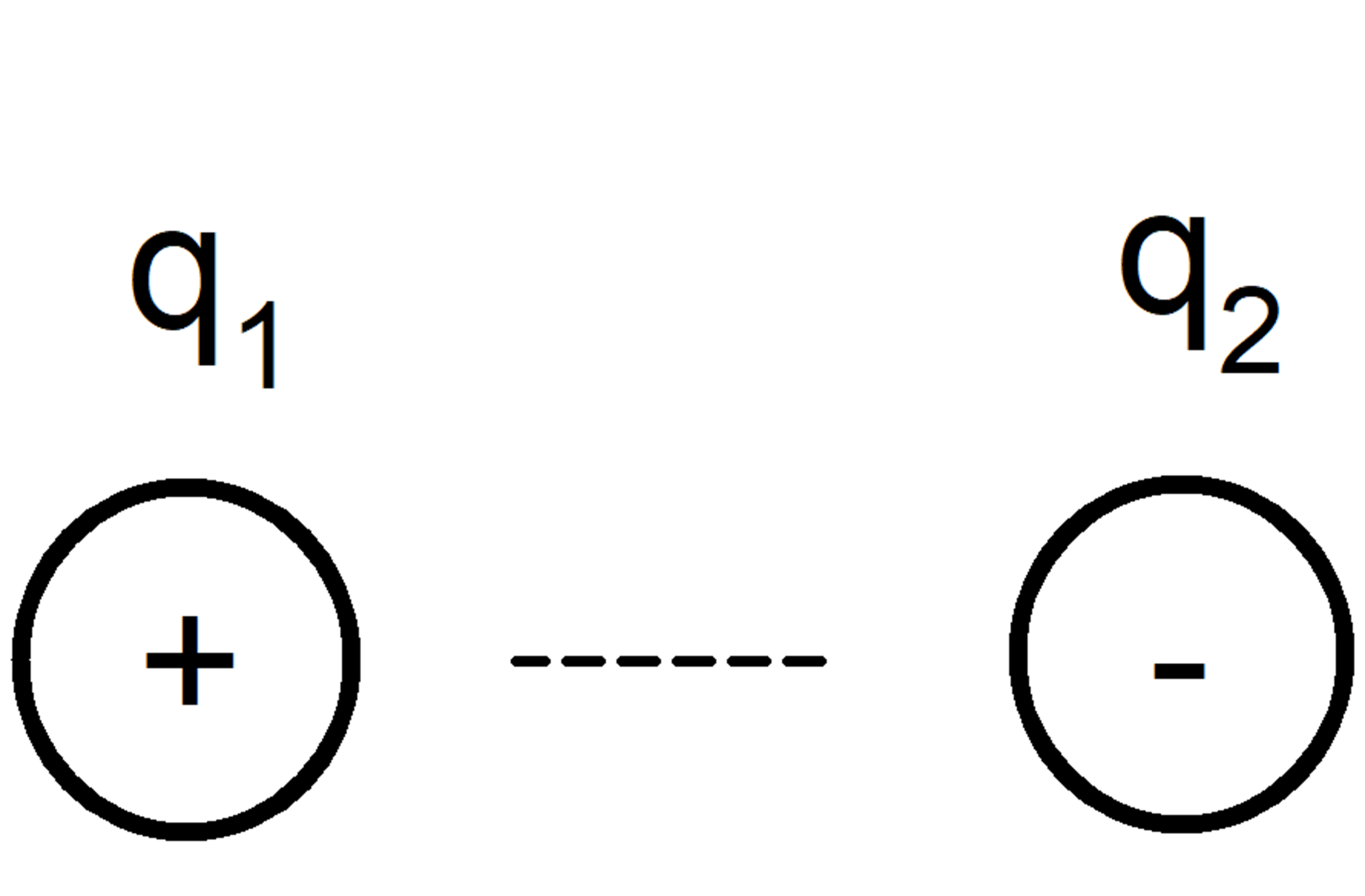
Fuerzas ión-dipolo

Son fuerzas de atracción entre un ion (un átomo cargado) y una molécula polar. El dipolo (generado en la molécula polar) se junta con el ion a través de su extremo con carga contraria a la del ion, con una intensidad proporcional a la carga del ion.
Pueden juntarse muchos dipolos de esta manera, si el ion es lo bastante grande. Estas son las fuerzas que intervienen en la disolución de sales, por ejemplo.
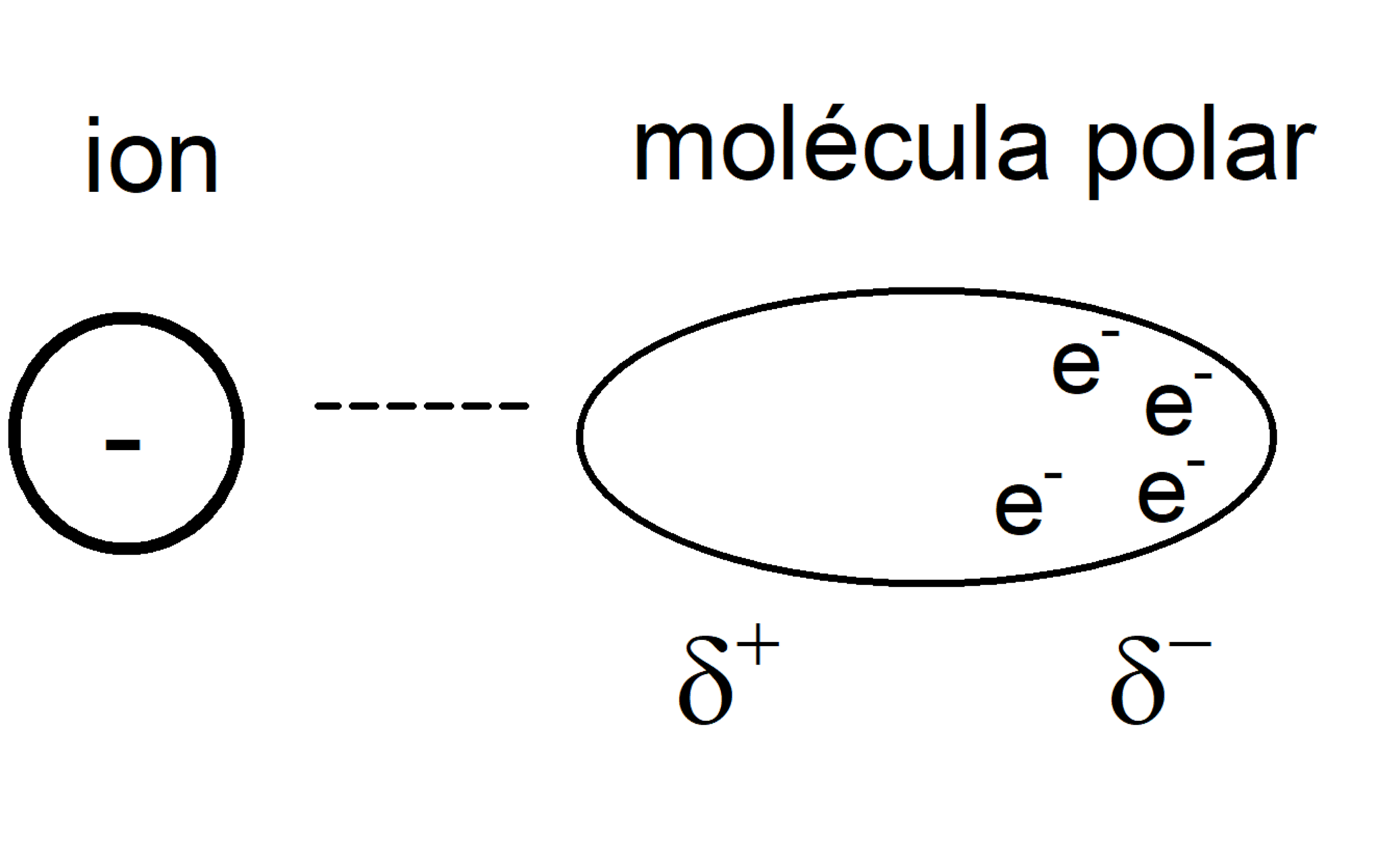
Fuerzas ion-dipolo inducido
Muy semejantes al caso de ion y molécula polar, pero en lugar de esta última, se trata de una molécula apolar en la que un dipolo es inducido por el campo electrostático del ion, adquiriendo polaridad instantánea, pero de baja intensidad.
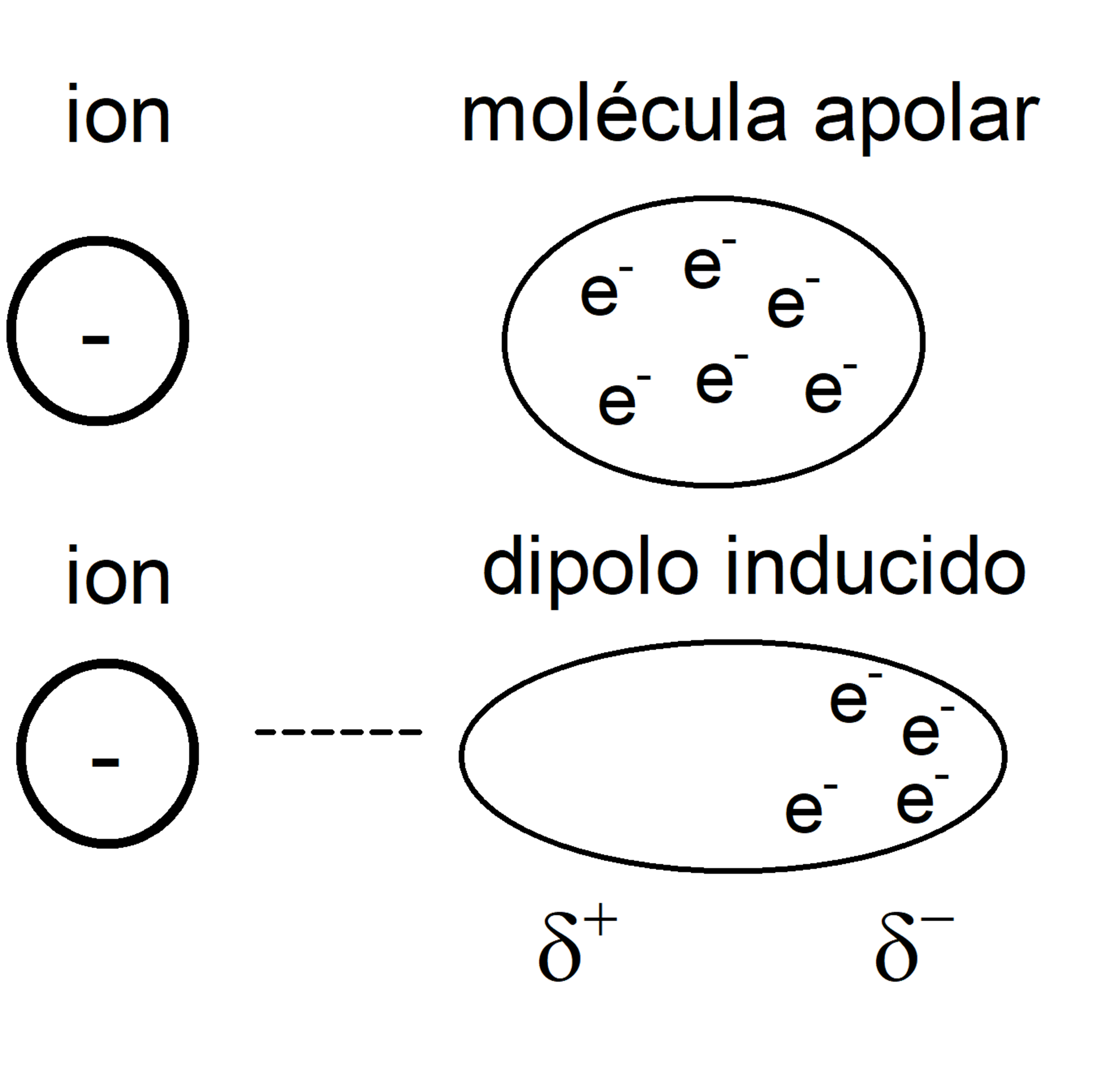
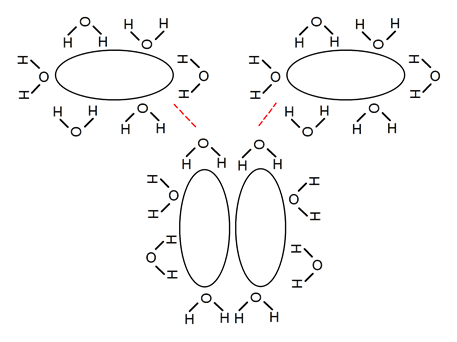
Fuerzas hidrofóbicas
Se llama así a las fuerzas de repulsión que determinadas moléculas presentan ante el agua, como es el caso de muchos lípidos.
Estas moléculas, en su empeño por minimizar la superficie que interactúa con un medio acuoso, se organizan a sí mismas formando agregados supramoleculares.
Este tipo de construcciones moleculares son fundamentales para la vida ya que en muchos casos permiten la construcción de membranas biológicas.
Puentes de hidrógeno
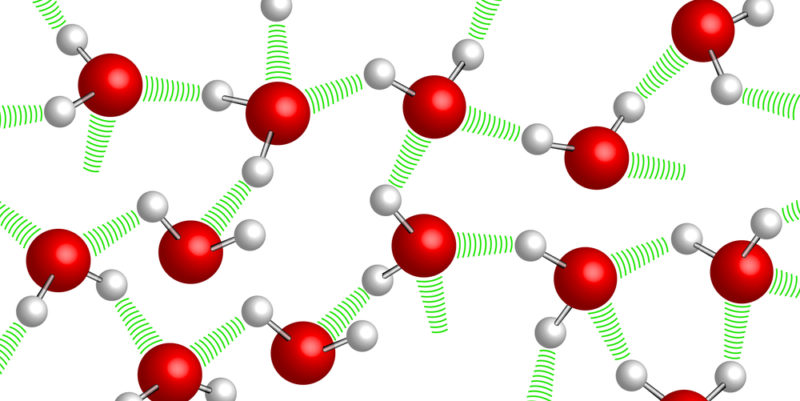
Los enlaces por puente de hidrógeno tienen lugar cuando en un compuesto químico un átomo de hidrógeno se enlaza con otro fuertemente electronegativo, como nitrógeno, oxígeno o flúor.
Esto le deja al hidrógeno una leve carga electropositiva parcial, lo suficiente como para interactuar nuevamente con otros átomos electronegativos (los mismos N, O y F) de otra molécula, haciendo de puente o enlace entre las dos.
Estos enlaces serán más fuertes mientras más electronegativo sea el átomo enlazado con hidrógeno.
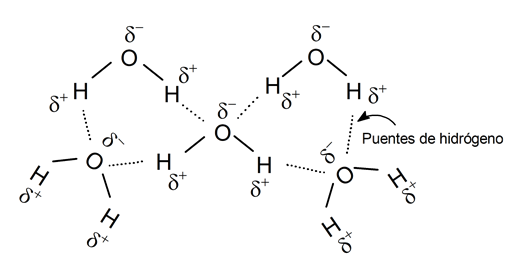
Fuerzas de Van der Waals
Se conoce con este nombre a determinadas fuerzas atractivas y/o repulsivas entre moléculas que no tienen que ver con enlaces intramoleculares (covalentes, iónicos, metálicos) sino con su naturaleza electromagnética o polar en casos muy específicos. Las fuerzas de Van der Waals son:
- Fuerzas dipolo-dipolo. Se trata de fuerzas entre dos dipolos permanentes, conocidas como fuerzas de Keesom. Estas interacciones ocurren entre moléculas polares, que tienen un polo positivo (densidad de carga 𝛿+) y uno negativo (densidad de carga 𝛿-), por lo que el polo positivo interactúa con el negativo. Para romperlas hace falta introducir más energía de la que sería necesaria para separar moléculas no polares. Los puentes de hidrógeno se consideran a menudo un ejemplo de esto.

- Fuerzas dipolo-dipolo inducido. Son fuerzas que se generan cuando un dipolo induce un dipolo en una molécula apolar, por lo que son interacciones que ocurren entre moléculas polares y apolares. Luego este dipolo inducido podrá interactuar con otro dipolo, como si se tratase de las fuerzas de Keesom. Por esta razón puede disolverse, por ejemplo, gases no polares (como el Cl) en solventes polares.

Fuerzas de dispersión de London
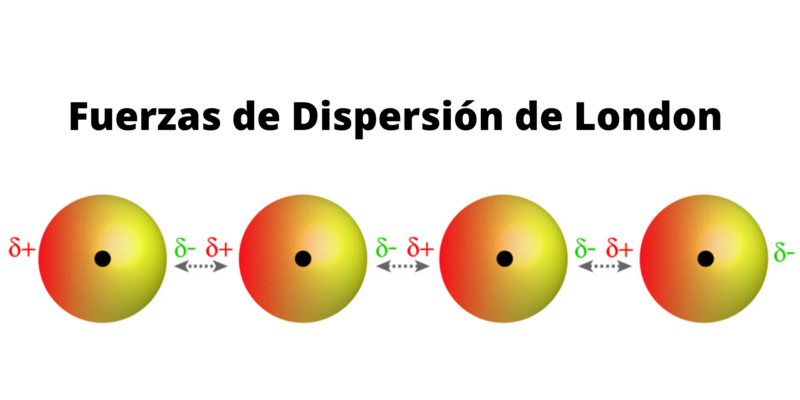
Consideradas a menudo entre las Fuerzas de Van der Waals (y llamadas fuerzas dipolo instantáneo-dipolo inducido), ocurren solo entre moléculas apolares que al aproximarse sufren una distorsión en sus nubes electrónicas y producen recíprocamente dipolos inducidos transitorios.
Esto luego les permitirá juntarse, mediante sus extremos opuestos eléctricamente, con una fuerza proporcional a la cantidad de electrones que presenten y que se han visto, por ende, distribuidos de otra forma.
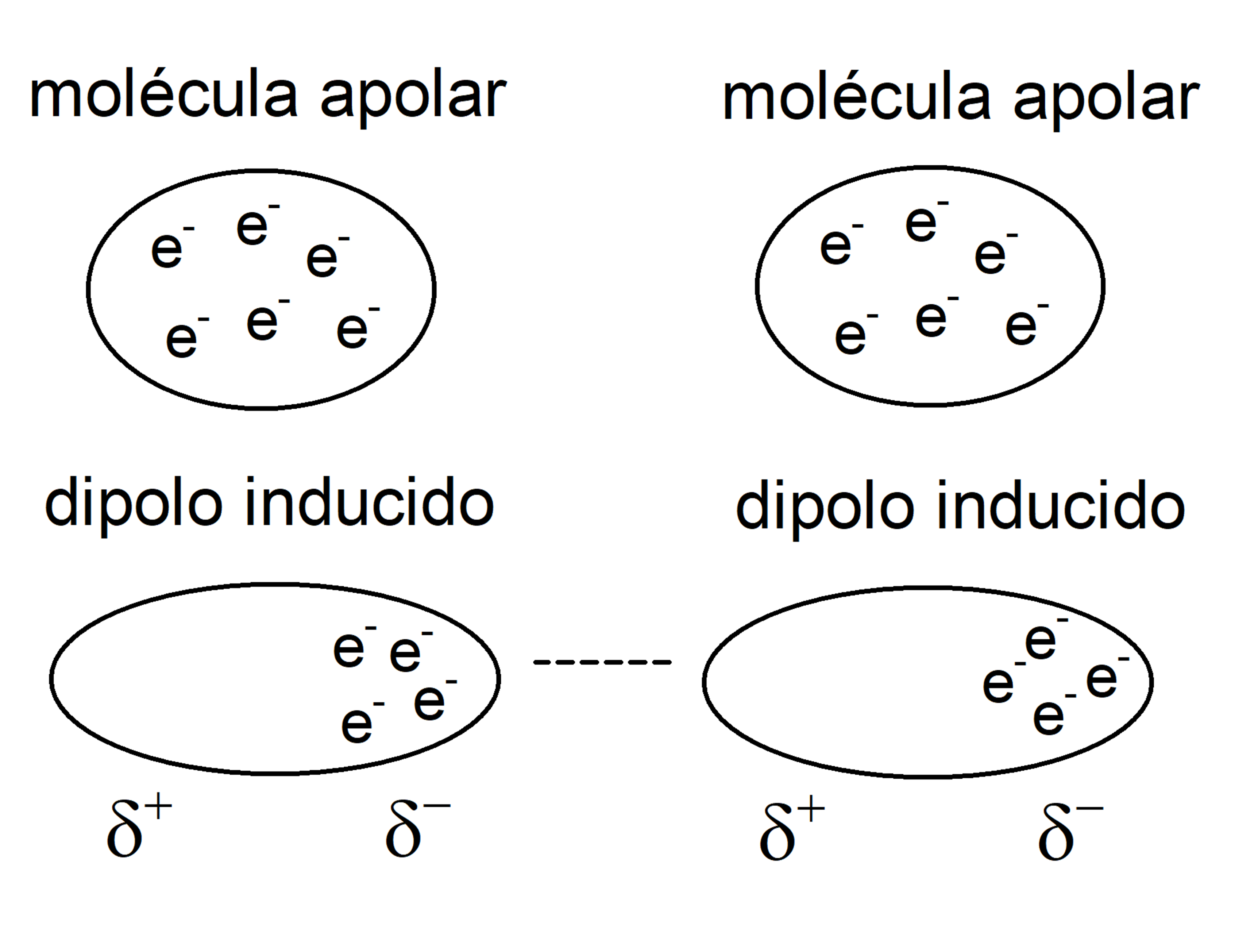
Ejemplos de compuestos que tienen fuerzas moleculares
- Membranas celulares. La doble capa de lípidos que rodea nuestras células funciona en base a fuerzas hidrofóbicas, que ordenan a todos los lípidos de la misma manera, con sus cabezas hidrofílicas hacia afuera y sus cuerpos hidrófobos hacia adentro de la célula.
- Hebras del ADN. La doble hélice del ADN se mantiene unida a través de puentes de hidrógeno que le confieren su estructura fija acostumbrada.
- Enzimas. Reaccionan ante sus sustratos, atraídas por una fuerza ion-ion que le garantiza una atracción fuerte y permanente.
- Disolución de las sales. Por ejemplo, el cloruro de sodio (NaCl), tiene cargas eléctricas de sus iones (Na+ y Cl-) que interactúan con las densidades de cargas eléctricas del dipolo del agua formando interacciones ion-dipolo.
Sigue con: Polímeros
Referencias:
- “Fuerza intermolecular” en Wikipedia.
- “Fuerzas intermoleculares” en Curso de biomoléculas de la Universidad del País Vasco Euskal Herriko Umbertsitatea.
- “Fuerzas intermoleculares” en PortalEducativo.
- “¿Qué son las fuerzas intermoleculares?” en La Web de los Adhesivos.
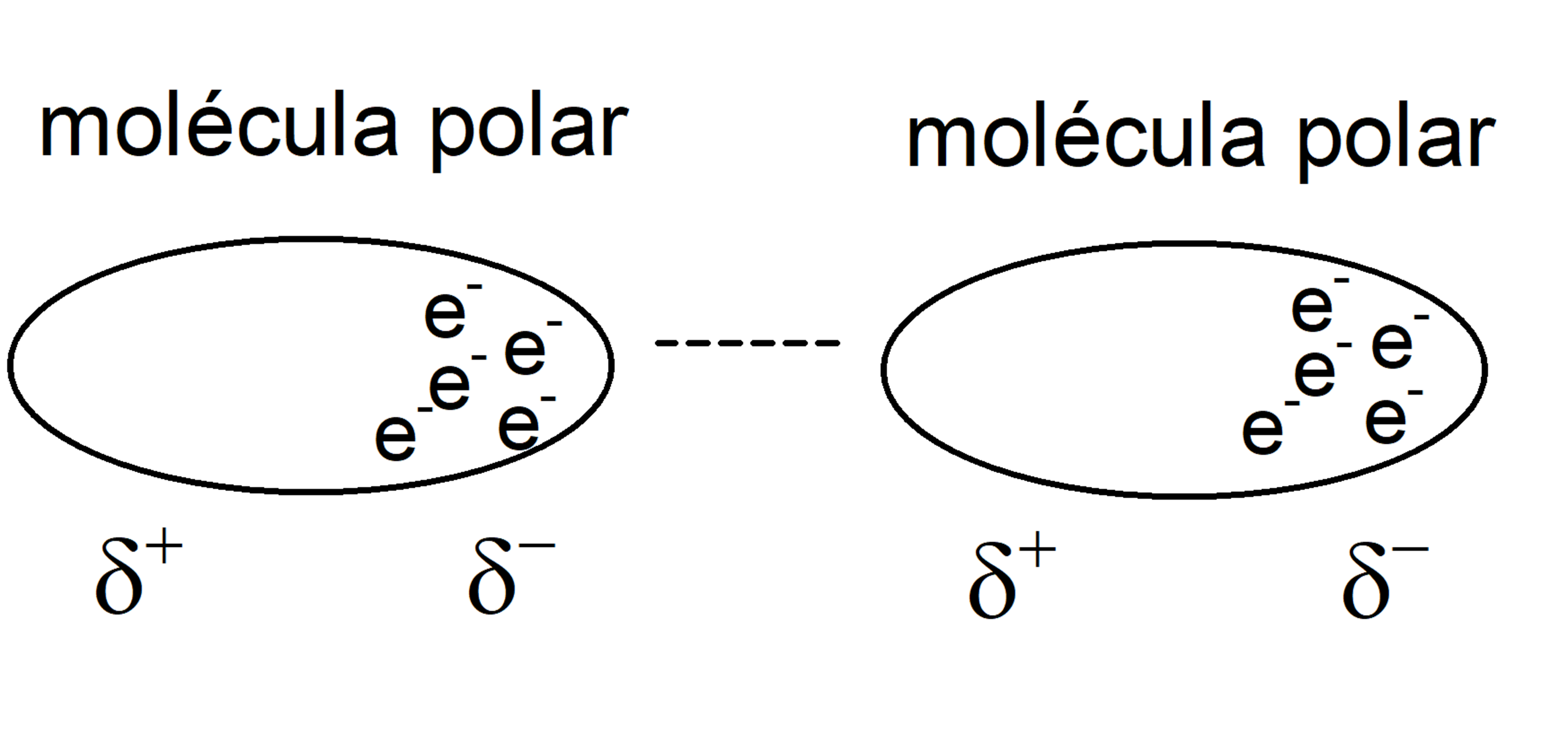
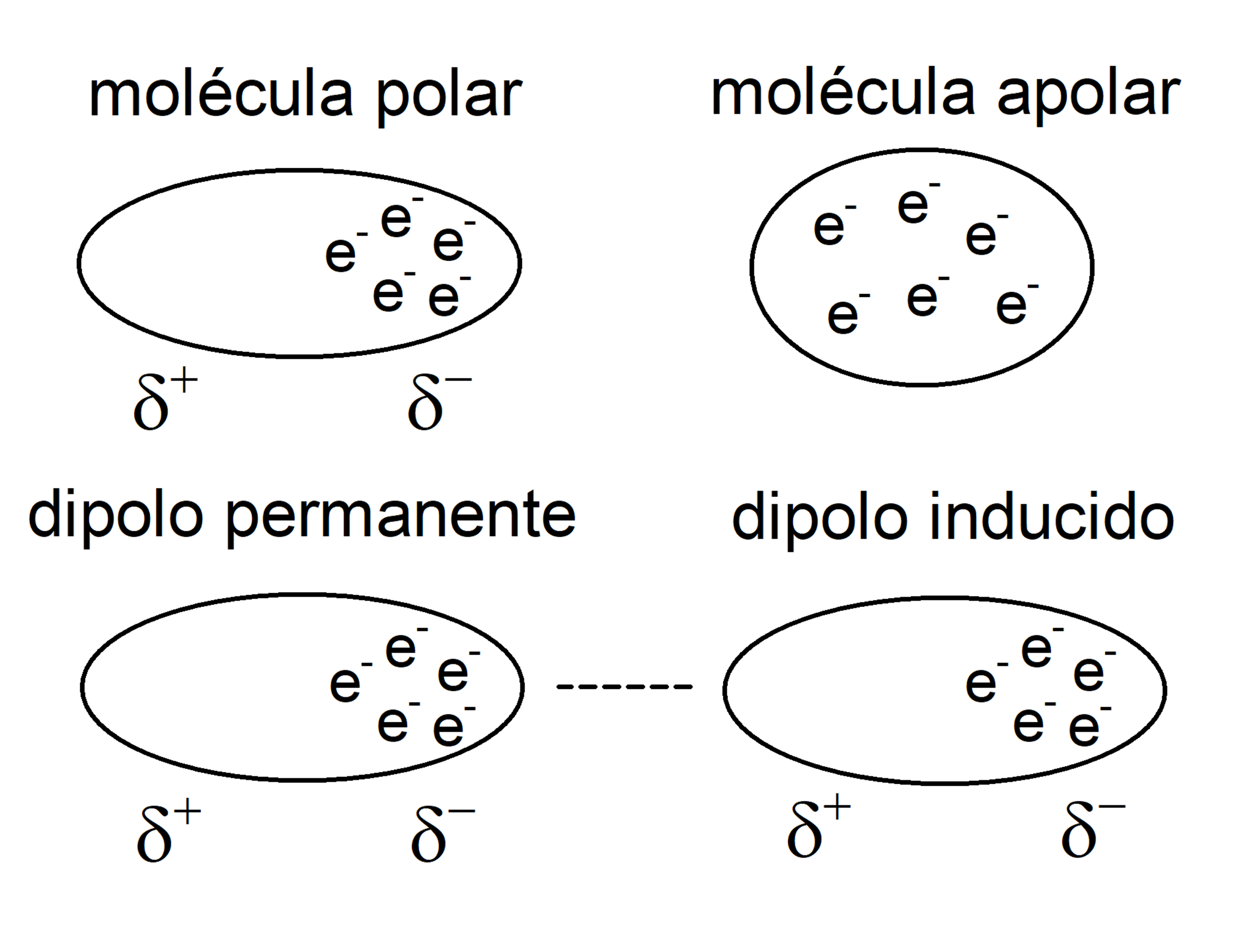
¿Te fue útil esta información?
Sí No¡Genial! Muchas gracias por visitarnos :)